RX108临床试验,RX108注射液晚期恶性实体肿瘤患者I期临床试验
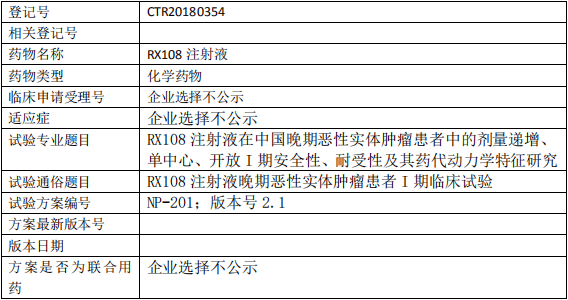
1、试验目的
主要目的: 探索 RX108 注射液连续给药在人体内的最大耐受剂量(MTD)和安全性、耐受性;
次要目的: 评估药代动力学特征; 初步评估 RX108 注射液应用于晚期实体肿瘤患者的抗肿瘤疗效。
2、试验设计
试验分类:其他其他说明
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 70 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.年龄在 18 岁至 70 岁;2.经组织学或细胞学检查确诊,常规治疗失败或无常规标准治疗的转移性或局部晚期实体肿瘤患者
3.按照 RECIST1.1 版标准具有可评估或可测量病灶的肿瘤(脑转移病灶不作为唯一可评估或可测量病灶)
4.预期生存时间≥3 个月
5.能够和研究人员交流并能理解和遵守所有的研究要求;
6.ECOG 体力评分 0 至 1 分
7.育龄期患者(无论男女)愿意在签署知情同意书后直至最后一剂研究治疗后 3 个月期间避孕,包括但不限于:激素避孕、或物理避孕、或禁欲)。育龄女性患者在计划开始第一剂研究药物治疗前 7 天内尿妊娠试验阴性
8.患者签署书面知情同意书
排除标准
1.患者在签署知情同意书之前 28 天或 5 个半衰期(以时间长的为准)内曾接受过抗肿瘤治疗(化疗、放疗、生物治疗、激素治疗),或者距末次口服氟尿嘧啶类药物 14 天内;或者患者仍存在由以前的抗肿瘤治疗所引起的的毒性反应(CTCAE 4.03 版,≥2 级)(脱发除外)
2. 在签署知情同意书前 28 天内接受过重大外科手术,如:剖腹手术、胸廓切开术、或脏器摘除术)
3. 患者在参与本研究期间计划择期手术
4. 有脑转移或者脑膜转移的病史记录或者症状的患者,脑转移病灶临床稳定可以进入本试验,定义为在签署知情同意书前 4 周内没有相关症状,同时经评估研究期间不需要进一步放疗、手术切除或者服用类固醇
5. 患者存在未被控制的疾病,包括不限于:
- 凝血障碍或出血性疾病;
- 患有活动性感染需要全身性抗生素治疗;
- ≥2级(CTCAE4.03 版)电解质紊乱
- 充血性心力衰竭(NYHA 心功能分级为 II 级或以上);
- 左心室射血分数< 50%; - 签署知情同意书前 6 个月内有中风、瞬时性脑缺血或其它 3-4 级动脉栓塞事件; -未被控制的高血压,定义为经标准治疗收缩压仍>140 mmHg 或者舒张压>90mmHg;
- 需 要 治 疗 的 心 律 失 常(CTCAE 4.03 版≥2 级),或者持续无症状室性心动过速;
-签署知情同意书前 6 个月内发生心肌梗死或不稳定性心绞痛;
- 研究者判断任何其他没有控制的严重疾患
6. 患者需要长期接受非甾体类抗炎药治疗(如:消炎痛、布洛芬、奈普生等),或者抗血小板药物(如:氯吡格雷、噻氯匹定、潘生丁、或阿那格雷)。或患者目前每天需服用阿司匹林剂量>300mg
7. 长期使用免疫抑制剂及肾上腺皮质激素者
8. 曾经入选过本研究或接受过本研究治疗
9. 同时或入组前 28 天内参加过其他临床研究
10. 参加了本研究的计划和执行过程(如研究申报单位及研究中心员工及其家属)
11. 怀孕或者哺乳期女性
12. 酗酒或药物滥用13. 研究者判断,患者因任何原因不适合参与本研究
研究者信息
1、主要研究者信息
姓名:李进
学位:医学博士
职称:主任医师
单位名称:上海市东方医院
2、各参加机构信息
机构名称:上海市东方医院
(主要)研究者:李进
国家:中国
省(州)-城市:上海 -上海




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城